Ортоарсенатна кислота Зміст Хімічні властивості |...
Неорганічні кислотиСполуки арсену
кислотаортофосфатнуводіспиртіОтруйнаінсектицидівскладисоціюєарсенатівнатріюлужних металівамоніютетраедраатомАрсенузв'язківнмсріблаоксид арсену (V)нітратної кислоти
| Ортоарсенатна кислота | |
|---|---|
 | |
 | |
Систематична назва | ортоарсенатна кислота |
| Інші назви | миш'якова кислота, ортомиш'якова кислота, арсенатна кислота, ортоарсенова кислота |
| Ідентифікатори | |
| Номер CAS | 7778-39-4 |
| PubChem | 234 |
| Номер EINECS | 231-901-9 |
| KEGG | C01478 |
| ChEBI | 18231 |
| RTECS | CG0700000 |
| SMILES | O[As](=O)(O)O |
| InChI | 1S/AsH3O4/c2-1(3,4)5/h(H3,2,3,4,5) |
| Номер Гмеліна | 2294 |
| Властивості | |
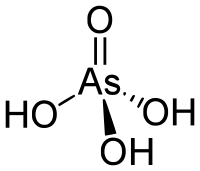
Молекулярна формула | H3AsO4 |
Молярна маса | 141,94 г/моль |
| Зовнішній вигляд | безбарвні кристали |
Густина | 2,6 г/см3 |
Тпл | 35,5 °C |
Ткип | розклад при > 100 °C |
Розчинність (вода) | 16,7 г/100 мл |
Кислотність (pKa) | 2,19, 6,94, 11,5 |
| Небезпеки | |
Класифікація ЄС | |
NFPA 704 |  0 3 0 |
Температура спалаху | Незаймиста |
| Якщо не зазначено інше, дані приведені для речовин у стандартному стані (за 25 °C, 100 кПа) | |
Інструкція з використання шаблону | |
Примітки картки | |
О́ртоарсена́тна кислота — триосновна неорганічна кислота середньої сили складу H3AsO4, трохи слабша за ортофосфатну. Має вигляд білих прозорих кристалів. Розчинна у воді та спирті, осаджується із розчину у формі гемігідрату 2H3AsO4·H2O. Отруйна.
Кислота використовується при виробництві дезінфікуючих засобів, інсектицидів та скла.
Зміст
1 Хімічні властивості
2 Отримання
3 Посилання
4 Джерела
Хімічні властивості |
У водному розчинні арсенатна кислота дисоціює:
- H3AsO4
 H2AsO−4 + H+ (K1 = 6,3 ×10−3)
H2AsO−4 + H+ (K1 = 6,3 ×10−3) - H2AsO−4
 HAsO2−4 + H+ (K2 = 1,2 × 10−7)
HAsO2−4 + H+ (K2 = 1,2 × 10−7) - HAsO2−4
 AsO3−4 + H+ (K3 = 3,2 × 10−12)
AsO3−4 + H+ (K3 = 3,2 × 10−12)
Відповідно можливе утворення трьох рядів солей (арсенатів), наприклад для натрію: Na3AsO4, Na2HAsO4 та NaH2AsO4. Арсенати нерозчинні у воді, за винятком солей лужних металів і амонію.
Арсенат-іон має форму тетраедра, в центрі якого знаходиться атом Арсену, довжина зв'язків As—O 0,175 нм. Якісною реакцією на арсенат-іон є осадження іонами срібла з нейтрального або слаболужного розчину з утворенням арсенату срібла (Ag3AsO4) коричневого кольору.
Отримання |
Арсенатну кислоту можна отримати, розчинивши оксид арсену (V) у воді:
- As2O5 + 3H2O → 2H3AsO4
Проте частіше миш'якову кислоту отримують дією концентрованої нітратної кислоти (HNO3) на As або As2O3:
- 3As2O3 + 4HNO3 → 6H3AsO4 + 4NO.
Посилання |
- http://www.termwiki.com/UK:arsenic_acid
- http://yugstal.dp.ua/kolorovi-metaly-mali-metaly/pro-myshyak/11/
- http://vseslova.com.ua/word/Миш'як-68863u
Джерела |
- Дроздов А.А., Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М. Неорганическая химия. — Москва : ИЦ «Академия», 2004. — Т. 2. — 368 с. — ISBN 5-7695-1436-1.
Романова Н.В. (1998). Загальна та неорганічна хімія. Київ; Ірпінь: ВТФ «Перун». с. 480. ISBN 966-569-106-6.